Principio Pauli
Il principio di Pauli - o "divieto di Pauli" così come "principio di esclusione di Pauli" - è una legge della fisica, più precisamente una legge del campo della fisica quantistica. La scoperta del principio di Pauli risale allo scienziato austriaco Wolfgang Ernst Pauli, che lo utilizzò per formulare uno dei principi fondamentali della meccanica quantistica nel 1925.
Piccolo promemoria: La meccanica quantistica si occupa delle leggi e degli stati della materia e di come possono essere calcolate le loro proprietà fisiche (a partire dalla dimensione degli atomi). Ciò rende il principio di Pauli particolarmente rilevante per la chimica.
Principio di Pauli: Una definizione
Fondamentalmente, la definizione del principio di Pauli va oltre le norme che si applicano nella fisica classica. Ciò si basa sul presupposto che non è mai possibile determinare se due particelle in un atomo si trovino o meno nello stesso posto. La logica conseguenza: Inizialmente sono indistinguibili.Gli esperimenti hanno dimostrato che per gli orbitali (regioni estese contenenti diverse particelle) è possibile determinare una certa probabilità per calcolare dove si trovano gli elettroni in essi. Le aree occasionalmente si sovrappongono, quindi anche le particelle possono trovarsi nello stesso posto.
È qui che entra in gioco il principio fisico di Pauli: Due elettroni non possono mai avere gli stessi numeri quantici. Queste misure delle proprietà di moto di un elettrone forniscono informazioni sull'orbitale, sul momento angolare e sullo spin. Il principio di Pauli afferma che due elettroni devono differire in almeno uno dei loro numeri quantici. Si applica quindi a tutte le particelle con spin semintero, chiamate fermioni. Oltre agli elettroni, questo include anche protoni e neutroni. I cosiddetti bosoni, responsabili della trasmissione delle forze, non sono soggetti al principio di Pauli.
Forma generale:
La funzione d'onda totale 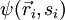 di un sistema n fermioni è totalmente antisimmetrico rispetto allo scambio di due particelle:
di un sistema n fermioni è totalmente antisimmetrico rispetto allo scambio di due particelle:
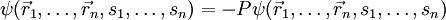
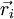 sono la posizione e si dell'orientamento di spin dell'i- esimo fermione. Inoltre, P è l'operatore di permutazione, che provoca lo scambio di due particelle, quindi risulta la formula:
sono la posizione e si dell'orientamento di spin dell'i- esimo fermione. Inoltre, P è l'operatore di permutazione, che provoca lo scambio di due particelle, quindi risulta la formula:
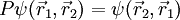 .
.
La conseguenza del principio di Pauli
Caratterizzando i fermioni nel principio di Pauli, si può dimostrare che solo due elettroni possono trovare spazio al di fuori del nucleo atomico in un orbitale. Dal punto di vista odierno ciò significa: se vengono scambiati fermioni identici, la funzione d'onda di un sistema quantistico diventa antisimmetrica. In questo modo si possono trarre conclusioni precise sulla struttura e la differenziazione (tavola periodica) della materia. Inoltre, l'interazione di scambio degli elettroni, che definisce il principio di Pauli, è responsabile del magnetismo.
Interpretazione esatta della regola di Pauli
L’antisimmetrico totale di una funzione d'onda significa che cambia segno quando due particelle vengono scambiate. In fisica, antisimmetrica significa che due fermioni non possono mai occupare lo stesso stato quantico: Se due fermioni hanno la stessa posizione e lo stesso numero quantico di spin, uno scambio formale dei due fermioni non cambia la funzione d'onda, perché sono indistinguibili. L'unica soluzione è quindi una funzione d'onda totale nulla a causa di Ψ = - Ψ, cioè Ψ = 0.
Nel caso di una separazione in funzione d'onda di posizione e funzione d'onda di spin, l'antisimmetrica della funzione d'onda complessiva con una funzione d'onda di posizione simmetrica richiede una funzione d'onda di spin antisimmetrica - e viceversa. Una funzione d'onda di spin (anti)simmetrica indica un orientamento di spin a coppie (anti)parallelo. Si ottiene la soluzione banale di una funzione d'onda spaziale antisimmetrica se le particelle elementari che si scambiano a coppie si trovano nello stesso posto (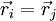 ).
).
 Migliaia di prodotti in stock
Migliaia di prodotti in stock